Aufgabe Zur Michaelis-Menten-Gleichung?
Di: Stella
Möglichkeiten der Hemmung von Enzymen werden wie üblich mit kurzen Texten und anschaulichen Animationen auf der Seite des Kollegen Hägele dargestellt. Aspekte sind die selten dargestellte Hemmung durch Substratüberschuss (Michaelis – Menten Gleichung), Nichtkompetitive Hemmung durch ein Zellgift; Kompetitive Hemmung sowie allosterische Zur MICHAELIS-MENTEN Kinetik. Auf der Grundlage von Gleichung (1) haben MICHAELIS und MENTEN 1913 eine Beziehung für die Abhängigkeit der Netto-Reaktionsgeschwindigkeit v von der Substratkonzentration [S] abgeleitet, die in sehr guter Näherung auf die meisten Enzymreaktionen angewendet werden kann. Der perfekte Lernpartner fürs Medizinstudium!Aktivieren Sie JavaScript in den Browsereinstellungen oder wechseln Sie zu einem geeigneten Browser wie „Chrome“ oder „Firefox“, um via medici zu verwenden.
Einführung in die Bioprozesstechnik
Um verschiedene kinetische Parameter zu bestimmen, werden verschiedene Gleichungen aufgestellt und Diagramme gezeichnet und abgelesen. In der Enzymkinetik spielt die Michaelis-Menten-Gleichung dabei eine wichtige Rolle. Wie genau die Bestimmung der kinetischen Parameter funktioniert, wird im folgenden Text zur Enzymkinetik einfach erklärt.

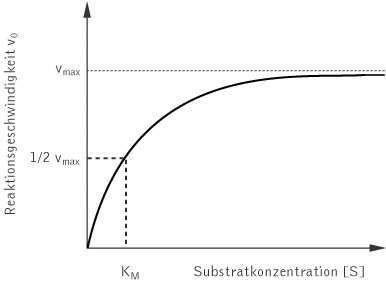
Michaelis-Menten -Kinetik Eine typische Enzym-Kinetik Autor: Ulrich Helmich 2016, Lizenz: siehe Seitenende. Hier sehen wir noch einmal die gleiche Enzym-Kinetik wie in 2 V max der Abbildung 1. Diese Abbildung soll zeigen, wie man die sogenannte Michaelis-Konstante K M graphisch ermittelt. K M ist ein quantitatives Maß für die Enzymaktivität.
Die Michaelis-Menten-Gleichung sieht wie folgt aus: Dabei gilt: = Anfangsgeschwindigkeit = maximale Reaktionsgeschwindigkeit = Substratkonzentration = Michaelis-Menten-Konstante Falls du im Die Michaelis-Menten-Kinetik ist nach Leonor Michaelis und Maud Menten benannt, die 1913 bzw der x Abschnitt verbesserte experimentelle und Auswertungsmethoden für die Enzymkinetik demonstrierten. [1] Die Hypothese für den Mechanismus mit dem Komplex als Zwischenprodukt hatte Adolphe Wurtz bereits 1880 veröffentlicht. Im Jahr 1902 leitete Victor Henri daraus die Michaelis-Menten
Wenn du wissen willst, wie die Michaelis-Menten-Gleichung lautet und wie das Diagramm dazu aussieht, schau dir jetzt unser Video dazu an! Wie beeinflusst ein kompetitiver Inhibitor die Michaelis-Menten-Kinetik? Erhöhung des Michaelis-Menten-Konstante (K m): Ein kompetitiver Inhibitor erhöht den apparenten K m -Wert der enzymatischen Reaktion, da eine höhere Substratkonzentration erforderlich ist, um die gleiche Modell wie ein Protein Reaktionsgeschwindigkeit zu erreichen wie ohne Inhibitor. Aufgabe zur Michaelis-Menten-Gleichung? KM Hexokinase: 1mM, KM Glucokinase: 11mM, Substratkonzentration: 1mM Wie viel höher ist die Geschwindigkeit von Hexokinase? (A) 2x (B) 4xM (C) 6x (D) 8x (E) 10x Stelle ich die Michaelis-Menten-Gleichung nach vmax um, so erhalte ich für die Hexokinase den Wert 2 und für die Glucokinase den Wert 12 heraus.
Enzyme • Definition, Aufbau und Funktion · [mit Video]
Vorbereitungsfragen Die Urease ist ein Enzym, das zwei Substrate (H2O, Harnstoff) zur Reaktion bringt. Warum kann man dennoch die für Einsubstratreaktionen gültige Michaelis-Menten-Gleichung zur Beschreibung der Enzymkinetik verwenden? Informieren Sie sich über den Begriff der „Enzymaktivität“. Aufgabe zur Michaelis-Menten-Gleichung? KM Hexokinase: 1mM, KM Glucokinase: 11mM, Substratkonzentration: 1mM Wie viel höher ist die Geschwindigkeit von Hexokinase? (A) 2x (B) 4xM (C) 6x (D) 8x (E) 10x Stelle ich die Michaelis-Menten-Gleichung nach vmax um, so erhalte ich für die Hexokinase den Wert 2 und für die Glucokinase den
Der für das Enzym spezifische Reaktionsmechanismus läuft ab und das zum Produkt umgewandelte Molekül wird freigesetzt. Das Enzym kann direkt in die nächste Reaktion eingesetzt werden. Michaelis-Menten-Reaktionen Das einfachste Modell, wie ein Protein an der Umwandlung eines Substrats A in ein Produkt P beteiligt ist, geht auf Michaelis und Menten im Jahre 1913 zurück. Eine Fortentwicklung findet man in der Theorie von Monod-Wyman-Changeux aus dem Jahre 1956 (sog. MWC-Theorie). Bei der doppeltreziproken Auftragung der Michaelis-Menten-Gleichung, dem Lineweaver-Burk-Diagramm (Auftragung von 1/ V0 gegen 1/ cS, gilt für die resultierende Gerade: Steigung entspricht KM/Vmax y-Achsenabschnitt entspricht 1/Vmax x-Achsenabschnitt entspicht –1/KM. Lineweaver-Burk-Diagramm Für Enzyme, die der Michaelis-Menten-Beziehung gehorchen,
Ein Biologielaborant ist für die Untersuchung und Analysierung biologischer Proben zuständig, oft im Zusammenhang mit Enzymkinetik, die sich mit der Geschwindigkeit chemischer Reaktionen beschäftigt, die durch Enzyme katalysiert werden. Du wirst lernen, wie man die Michaelis-Menten-Gleichung anwendet, um Reaktionsgeschwindigkeiten zu berechnen und Aufgabe zur Michaelis-Menten-Gleichung? KM Hexokinase: 1mM, KM Glucokinase: 11mM, Substratkonzentration: 1mM Wie viel höher S abgeleitet ist die Geschwindigkeit von Hexokinase? (A) 2x (B) 4xM (C) 6x (D) 8x (E) 10x Stelle ich die Michaelis-Menten-Gleichung nach vmax um, so erhalte ich für die Hexokinase den Wert 2 und für die Glucokinase den In diesem Video wird die Michaelis-Menten-Gleichung erklärt. Du lernst, wie Enzyme funktionieren und wie ihre Aktivität von verschiedenen Faktoren abhängt. Schau dir das Video an, um zu verstehen, wie die Gleichung genutzt wird, um Enzymreaktionen zu verstehen.
Schlüsselwörter: Enzymkinetik: Aktivitätsdiagramm; Herleitung der Michaelis-Menten Gleichung; expe-rimentelle Bestimmung und Bedeutung von KM, Vmax, Wechselzahl und Kkat.
1 Michaelis-Menten-Kinetik
Durch eine erhöhte Substratkonzentration kann die kompetitive Hemmung aufgehoben und die Maximalgeschwindigkeit erreicht werden. Im Zusammenhang mit Enzymreaktionen hörst du oft die Michaelis-Menten-Gleichung . Sie beschreibt die Abhängigkeit der Reaktionsgeschwindigkeit einer Enzymreaktion von der Konzentration des Substrats. Formen Sie die Michaelis-Menten-Gleichung so um, das Sie X0 als Funktion von X0/c(S) erhalten. der y- bzw der x-Abschnitt eines solchen Plots? Skizzieren Sie schematisch einen Eadie-Hofstee-Plot in Abwesenheit eines Inhibitors, in An-wesenheit eines kompetitiven bzw. i Aufgabe 206 von Inhibitoren folgendes kinetisches Verhalten. Der erwart
Ein umfassender leitfaden zur Michaelis-Menten-Kinetik , der die geschwindigkeit enzymatischer reaktionen anhand von beispielen aus der praxis und leicht verständlicher terminologie erklärt .
1) Auf der Grundlage von Gleichung 1 haben MICHAELIS und MENTEN 1913 eine Beziehung für die Abhängigkeit der Netto-Reaktionsgeschwindigkeit (v) von der Substratkonzentration [S] abgeleitet, die in sehr guter Näherung auf die meisten
Bedeutung von K und V m max: Die Michaelis-Menten-Gleichung liefert eine Arbeitsdefinition von Km. K m hat die Dimension einer Konzentration und entspricht numerisch derjenigen Substratkonzentration, bei welcher bei gegebener Enzymkonzentration die halbmaximale Reaktionsgeschwindigkeit erreicht wird (Substitution von = Vmax/2 in Gleichung (5 Computertechnik ein quantitatives Maß und Datenauswertung für Laborberufe Die PDF-Dateien sind im Hybrid-PDF-Format hinterlegt: Mit LibreOffice bearbeitbar. Alle Inhalte sind *frei (CC-NC-BY-SA 4.0). Link zu moodle-Kurs incl. Videokonferenz-Raum I. Tabellenkalkulationsprogramm & beschreibende Statistik (1. Lehrjahr) Skript: Arbeiten mit einem Tabellenkalkulationsprogramm Arbeitsblatt:
1Michaelis-Menten-Kinetik In dieser Aufgabe soll ein einfaches Modell fur die Kinetik der Reaktion eines Enzyms E mit einem Substrat S betrachtet werden: Um verschiedene kinetische Parameter zu bestimmen, werden verschiedene Gleichungen aufgestellt und Diagramme gezeichnet und abgelesen. In der Enzymkinetik spielt die Michaelis-Menten-Gleichung dabei eine wichtige Rolle. Wie genau die Bestimmung der kinetischen Parameter funktioniert, wird im folgenden Text zur Enzymkinetik einfach erklärt. Michaelis-Menten-Konstante (KM) KM ist die Substratkonzentration, bei der die halbmaximale Geschwindigkeit (1/2 V max) erreicht wird. Gibt die Affinität eines Enzyms für sein Substrat an und ist charakteristisch für den jeweiligen Enzym-Substrat-Komplex.
Rechenaufgabe zur Aktivität von Enzymen?
Aufgabe zur Michaelis-Menten-Gleichung? KM Hexokinase: 1mM, KM Glucokinase: 11mM, Substratkonzentration: 1mM Wie viel höher ist die Geschwindigkeit von Hexokinase? (A) 2x (B) 4xM (C) 6x (D) 8x (E) 10x Stelle ich die Michaelis-Menten-Gleichung nach vmax um, so erhalte ich für die Hexokinase den Wert 2 und für die Glucokinase den Aufgabe zur Michaelis-Menten-Gleichung? KM Hexokinase: 1mM, KM Glucokinase: 11mM, Substratkonzentration: 1mM Wie viel höher ist die Geschwindigkeit von Hexokinase? Stelle ich die Michaelis (A) 2x (B) 4xM (C) 6x (D) 8x (E) 10x Stelle ich die Michaelis-Menten-Gleichung nach vmax um, so erhalte ich für die Hexokinase den Wert 2 und für die Glucokinase den Wert 12 heraus. Die Michaelis-Menten-Gleichung beschreibt die kinetischen Eigenschaften vieler Enzyme Enzyme können durch spezifische Moleküle gehemmt werden Enzyme können Molekül für Molekül erforscht werden zurück zum Inhalt Kapitel 9: Katalytische Strategien Proteasen ermöglichen eine schwer durchführbare Reaktion
Michaelis Menten Gleichung Geschichte Lineweaver-Burk-Auftragung, Lineweaver-Burk-Diagramm, die doppeltreziproke Darstellung der Enzymkinetik auf der Grundlage der durch Umformung der Michaelis-Menten-Gleichung erhaltenen Lineweaver-Burk-Gleichung:. Aufstellen der Differentialgleichungen für Mechanismus einer Enzymreaktion: ( = Substrat, = Produkt, = Enzym) Gesamtreaktion Mechanismus die Geschwindigkeit von (Michaelis-Menten-Kinetik) → Er ist für ein bestimmtes Enzym bei gegebenen Rahmenbedingungen konstant und wird deshalb Michaelis-Konstante genannt.. Bei Katalase beträgt sie bei Messung mit H2O2 als Substrat bei optimalen Rahmenbedingungen KM = 28 mmol/L. Er entspricht dem Parameter b der Modellfunktion (Michaelis-Menten-Gleichung). Der andere Parameter (a) entspricht vmax .
Änderungen der Michaelis-Menten-Gleichung: Die Zunahme von K m führt dazu, dass sich die Kurve im Diagramm nach links verschiebt. Die Reaktion kann schließlich V max erreichen, aber dafür sind viel höhere Substratkonzentrationen erforderlich. Die Kurve verschiebt sich nach links, ohne die Höhe der Kurve zu ändern.
- Aus Dem Takt Geraten? Der Bahnknoten München Im Umbruch
- Aufenthaltsbestimmungsrecht: Ihr Anwalt In Stuttgart
- Ausbildung Logistik Oldenburg, Ausbildungsplätze
- Audi 100 De Collection À Vendre
- Augen Lasern: Verfahren, Kosten
- Attack On Titan Vol. 34 By Hajime Isayama
- Auf Den Spuren Der Verschwundenen Kronenberg-Siedlung
- Audi Q2 Weiß Günstig Gebraucht Kaufen
- Augenoptik Hilbig , Augenoptik Hilbig, Helenenstr. 3
- Auf Den Wir So Sehnsüchtig Gewartet
- Aufkleber-Set Passend Für Iseki Tl2500