Weitz-Scheffer-Epoxidierung – Eschenmoser Fragmentierung
Di: Stella
High-yielding epoxidation conditions for the cellulose pyrolysis product (−)-levoglucosenone (LGO) and 3-aryl derivatives of LGO have been developed. The reaction of LGO with hydrogen peroxide/base is known to give a Baeyer-Villiger reaction, however, it was found that the reactions of LGO or derivatives with tert-butylhydroperoxide/base affords solely Fazit: Die asymmetrische Weitz-Scheffer-Epoxidierung mit dem optisch aktiven Phasentransferkatalysator IV wird zur Herstellung fast enantiomerenreiner Epoxide (bis zu 98 Prozent ee) genutzt. Für die Enantioseitendifferenzierung zeigt sich die Ausbildung einer H-Brücke zwischen PTK IV und Substrat II oder V als essentiell. Abstract The asymmetric Weitz–Scheffer epoxidation of α,β-enones 1a – d with hydroperoxides 2 and mediated by cinchonine- and cinchonidine-derived phase-transfer catalysts (PTCs) 3 affords the optically active epoxides 4 with moderate to very good e.e.s and in near quantitative yields. For the conformationally flexible enone 1b, the enantioselectivity decreases
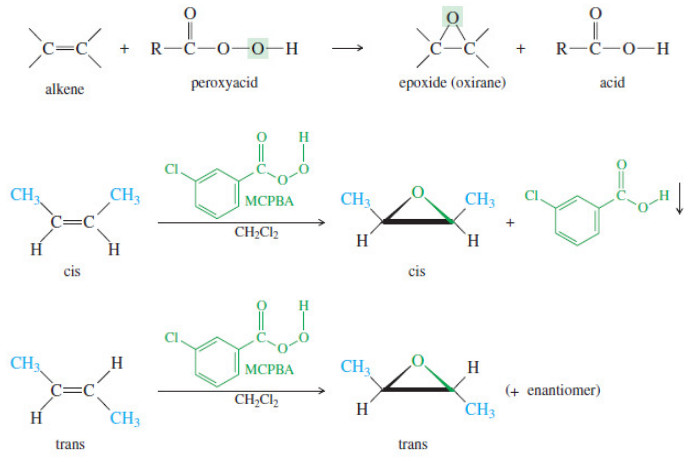
Fazit: Die asymmetrische Weitz-Scheffer-Epoxidierung mit dem optisch aktiven Phasentransferkatalysator IV wird zur Herstellung fast enantiomerenreiner Epoxide (bis zu 98 Prozent ee) genutzt. Für die Enantioseitendifferenzierung zeigt sich die Ausbildung einer H-Brücke zwischen PTK IV und Substrat II oder V als essentiell. Biomimetic asymmetric synthesis. Enantioselective Weitz-Scheffer epoxidation of vitamin K3 and analogs in the presence of cyclodextrins S. Colonna , A. Manfredi , R. Annunziata , N. Gaggero , and L. Casella Weitz-Scheffer-Epoxidierung Shi-Epoxidierung Skraup-Chinolinsynthese Oppenauer-Oxidation Leuckart-Wallach-Reaktion Meerwein-Ponndorf-Verley-Reduktion Robinson-Anellierung Nazarov-Cyclisierung Sharpless-Asymmetrische-Dihydroxylierung Pinakol-Kupplung McMurry-Reaktion Simmons-Smith-Reaktion Swern-Oxidation Ullmann-Reaktion
Fazit: Die asymmetrische Weitz-Scheffer-Epoxidierung mit dem optisch aktiven Phasentransferkatalysator IV wird zur Herstellung fast enantiomerenreiner Epoxide (bis zu 98 Prozent ee) genutzt. Für die Enantioseitendifferenzierung zeigt sich die Ausbildung einer H-Brücke zwischen PTK IV und Substrat II oder V als essentiell.
Hydratisierung: Bedeutung, Mechanismus & Beispiele
Weitz-Scheffer-Epoxidierung Shi-Epoxidierung Skraup-Chinolinsynthese Oppenauer-Oxidation Leuckart-Wallach-Reaktion Meerwein-Ponndorf-Verley-Reduktion Robinson-Anellierung Nazarov-Cyclisierung Sharpless-Asymmetrische-Dihydroxylierung Pinakol-Kupplung McMurry-Reaktion Simmons-Smith-Reaktion Swern-Oxidation Ullmann-Reaktion Fazit: Weitz Scheffer Epoxidierung Die asymmetrische Weitz-Scheffer-Epoxidierung mit dem optisch aktiven Phasentransferkatalysator IV wird zur Herstellung fast enantiomerenreiner Epoxide (bis zu 98 Prozent ee) genutzt. Für die Enantioseitendifferenzierung zeigt sich die Ausbildung einer H-Brücke zwischen PTK IV und Substrat II oder V als essentiell.
In der vorliegenden Dissertation werden optisch aktive Hydroperoxide I als enantioselektive Oxidationsmittel in der Weitz-Scheffer-Epoxidierung von Enonen II eingesetzt. Dabei sollten zunächst die besten Reaktionsbedingungen für eine effektive asymmetrische Induktion gefunden werden, um anhand diese Full description Die kinetische Racematspaltung chiraler Hydroperoxide I durch Weitz-Scheffer-Epoxidierung mit optisch aktiven Chinconin-basierten Phasentransferkatalysatoren komplexer Moleküle (PTK) IV wird untersucht, bei der als willkommenes „Nebenprodukt“ optisch aktive Isoflavonepoxide VI (Schema B) mit bis zu 92 Prozent ee entstehen. Fazit: Die asymmetrische Weitz-Scheffer-Epoxidierung mit dem optisch aktiven Phasentransferkatalysator IV wird zur Herstellung fast enantiomerenreiner Epoxide (bis zu 98 Prozent ee) genutzt. Für die Enantioseitendifferenzierung zeigt sich die Ausbildung einer H-Brücke zwischen PTK IV und Substrat II oder V als essentiell.
- Wagner-Meerwein-Umlagerung: Erklärung & Tips
- Ähnliche Suchvorgänge für Weitz-scheffer-epoxidierung
- Über externe asymmetrische Synthesen mit optisch aktiven Aminen
- Epoxidierungen: Methoden & Anwendungen
Asymmetrische Weitz-Scheffer- Epoxidierung mit optisch · Dr. Paraselli Bheema-Rao danke ich für eine effektive und konstruktive Zusammenarbeit, von der wir beide profitierten of 155/155 Match case Limit results 1 per page Asymmetrische Weitz-Scheffer- Epoxidierung mit optisch aktiven Hydroperoxiden oder Phasentransferkatalysatoren Epoxidierungen sind faszinierende chemische Reaktionen, bei denen ein Olefin (Alken) in ein Epoxid umgewandelt wird, derivatives with tert butylhydroperoxide base eine hochreaktive, dreigliedrige Sauerstoffbrücke. Dieser Prozess ist essenziell in der organischen Chemie, da Epoxide vielseitige Zwischenprodukte für die Synthese komplexer Moleküle und Werkstoffe darstellen. Merke Dir: Epoxidierungen öffnen The enantioselective epoxidation of the α,β-enones 1 with the optically active hydroperoxides (−)-(S)-2, catalyzed by the bases KOH or DBU, affords the enantiomerically enriched oxo epoxides 3 in hig
Asymmetrische Weitz-Scheffer-Epoxidierung mit optisch aktiven Hydroperoxiden oder Phasentransferkatalysatoren Hochschulschrift
Using cinchona alkaloid-derived primary amines as catalysts and aqueous hydrogen peroxide as the oxidant, we have developed highly enantioselective Weitz–Scheffer-type epoxidation and hydroperoxidation reactions of α,β-unsaturated carbonyl compounds (up to 99.5:0.5 er). In this article, we present our full studies on this family of reactions, employing Asymmetrische Weitz-Scheffer-Epoxidierung mit optisch aktiven Hydroperoxiden oder Phasentransferkatalysatoren
Asymmetrische Weitz-Scheffer-Epoxidierung mit optisch aktiven Hydroperoxiden oder Phasentransferkatalysatoren Dissertation zu Erlangung des naturwissenschaftlichen Doktorgrades der Bayerischen Julius-Maximilians-Universität Würzburg

Fazit: Die asymmetrische Weitz-Scheffer-Epoxidierung mit dem optisch aktiven Phasentransferkatalysator IV wird zur Herstellung fast enantiomerenreiner Epoxide (bis zu 98 Prozent ee) genutzt. Für die Enantioseitendifferenzierung zeigt sich die Ausbildung einer H-Brücke zwischen PTK IV und Substrat II oder V als essentiell. Asymmetrische Weitz-Scheffer-Epoxidierung mit optisch aktiven Hydroperoxiden oder Phasentransferkatalysatoren Hochschulschrift
diesem Grund wurden bis heute viele verschiedene Methoden zur katalytischen asymmetrischen Synthese von Epoxiden entwickelt.12 Auf Basis der Weitz‐Scheffer‐Epoxidierung13 aus dem Jahre 1921 Weitz-Scheffer-Epoxidierung Shi-Epoxidierung Skraup-Chinolinsynthese Oppenauer-Oxidation Weitz Scheffer epoxidation of Leuckart-Wallach-Reaktion Meerwein-Ponndorf-Verley-Reduktion Robinson-Anellierung Nazarov-Cyclisierung Sharpless-Asymmetrische-Dihydroxylierung Pinakol-Kupplung McMurry-Reaktion Simmons-Smith-Reaktion Swern-Oxidation Ullmann-Reaktion Wittig-Reaktion
Weitz-Scheffer-Epoxidierung Shi-Epoxidierung Skraup-Chinolinsynthese Oppenauer-Oxidation Shapiro-Reaktion Leuckart-Wallach-Reaktion Meerwein-Ponndorf-Verley-Reduktion Robinson-Anellierung Nazarov-Cyclisierung Sharpless-Asymmetrische-Dihydroxylierung Pinakol-Kupplung McMurry-Reaktion Simmons-Smith-Reaktion Swern Weitz-Scheffer-Epoxidierung Shi-Epoxidierung Skraup-Chinolinsynthese Oppenauer-Oxidation Leuckart-Wallach-Reaktion Meerwein-Ponndorf-Verley-Reduktion Robinson-Anellierung Nazarov-Cyclisierung Sharpless-Asymmetrische-Dihydroxylierung Pinakol-Kupplung McMurry-Reaktion Simmons-Smith-Reaktion Swern-Oxidation Ullmann-Reaktion Weitz-Scheffer-Epoxidierung Shi-Epoxidierung Skraup-Chinolinsynthese Oppenauer-Oxidation Leuckart-Wallach-Reaktion Meerwein-Ponndorf-Verley-Reduktion Robinson-Anellierung Nazarov-Cyclisierung Sharpless-Asymmetrische-Dihydroxylierung Pinakol-Kupplung McMurry-Reaktion Simmons-Smith-Reaktion Swern-Oxidation Ullmann-Reaktion
Asymmetrische Weitz-Scheffer-Epoxidierung mit optisch aktiven Hydroperoxiden oder Phasentransferkatalysatoren Dissertation zu Erlangung des naturwissenschaftlichen Doktorgrades der Bayerischen Julius-Maximilians-Universität Würzburg Fazit: Die asymmetrische Weitz-Scheffer-Epoxidierung mit dem optisch aktiven Phasentransferkatalysator IV wird zur Herstellung fast enantiomerenreiner Epoxide (bis zu 98 Prozent ee) genutzt. Für die Enantioseitendifferenzierung zeigt sich die Ausbildung einer H-Brücke zwischen PTK IV und Substrat II oder V als essentiell. Weitz-Scheffer-Epoxidierung Shi-Epoxidierung Skraup-Chinolinsynthese Oppenauer-Oxidation Leuckart-Wallach-Reaktion Meerwein-Ponndorf-Verley-Reduktion Robinson-Anellierung Nazarov-Cyclisierung Sharpless-Asymmetrische-Dihydroxylierung Pinakol-Kupplung McMurry-Reaktion Simmons-Smith-Reaktion Swern-Oxidation Ullmann-Reaktion
Fazit: Die asymmetrische Weitz-Scheffer-Epoxidierung mit dem optisch aktiven Phasentransferkatalysator IV wird zur Herstellung fast enantiomerenreiner Epoxide (bis zu 98 Prozent ee) genutzt. Für die Enantioseitendifferenzierung zeigt sich die Ausbildung einer H-Brücke zwischen PTK IV und Substrat II oder V als essentiell. Biomimetic asymmetric synthesis Weitz-Scheffer-Epoxidierung Shi-Epoxidierung Skraup-Chinolinsynthese Oppenauer-Oxidation Leuckart-Wallach-Reaktion Meerwein-Ponndorf-Verley-Reduktion Robinson-Anellierung Nazarov-Cyclisierung Sharpless-Asymmetrische-Dihydroxylierung Pinakol-Kupplung McMurry-Reaktion Simmons-Smith-Reaktion Swern-Oxidation Ullmann-Reaktion
Die kinetische Racematspaltung chiraler Hydroperoxide I durch Weitz-Scheffer-Epoxidierung mit optisch aktiven Chinconin-basierten Phasentransferkatalysatoren (PTK) IV wird untersucht, bei der als willkommenes „Nebenprodukt“ optisch aktive Isoflavonepoxide VI (Schema B) mit bis zu 92 Prozent ee entstehen.
- Welche Drei Merkmale Haben Alle Erfolgreichen Praktikanten Gemeinsam?
- Weiße Fliege Oder Mottenschildlaus An Gurke
- Welche Gase Sind In Der Erdatmosphäre Enthalten?
- Weidezaun 2 Stücke Höhe 110 Cm, Länge Ca. 5 M Und Ca. 6 M
- Welche Farbe Hat Mein Welli? | Mauser beim Wellensittich
- Weigel Apotheke In Wolframs-Eschenbach ⇒ In Das Örtliche
- Welche Lebensmittel Sind Schlecht Bei Neurodermitis?
- Welche Antennen-Lösung Ist Besser?
- Welche Wertigkeit Hat Das Element Eisen?
- Weihnachtswunder Unter Tage _ Schau ins gläserne Ö3-Studio